ул.Симферопольская
дом 5, офис 9
![]() Корзина
Корзина
Корзина пуста
Законы электролиза Фарадея. Формула закон электролиза
43.Электролиз. Законы электролиза
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплавэлектролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный[1]. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательныеионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений[источник не указан 1700 дней], диоксида марганца[2],пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция,электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит: если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональностиназываетсяэлектрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
(1)
(2)
(3)
(4)
, где z — валентность атома (иона) вещества, e — заряд электрона (5)
Подставляя (2)-(5) в (1), получим
где —постоянная Фарадея.
Второй закон Фарадея
Второй закон электролиза Фарадея: для данного количества электричества масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
где —постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
где —молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль; —сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А; — время, в течение которого проводился электролиз,с; —постоянная Фарадея,Кл·моль−1; — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
studfiles.net
Законы электролиза
Процессы электролиза подчиняются законам Фарадея:
Первый закон:
Масса электролита, подвергшаяся химическому превращению, а также массы веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшему через расплав или раствор электролита.
Второй закон:
При пропускании одинакового количества электричества через растворы или расплавы различных электролитов масса веществ, выделяющихся на электродах, пропорциональна их химическим эквивалентам.
Для расчетов используют объединенное уравнение законов Фарадея:
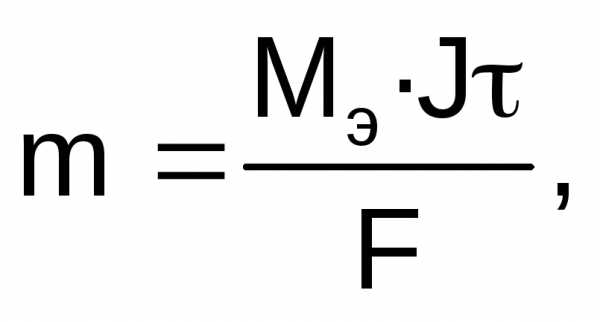
где m – масса электролита, подвергшаяся химическому превращению, или масса вещества, выделившегося на электроде, г; Мэ – молярная масса эквивалентов вещества, г/моль; J – сила тока, А; - время электролиза, с; F – число Фарадея (96500 Кл/моль).
Молярная масса эквивалентов вещества рассчитывается по формуле:
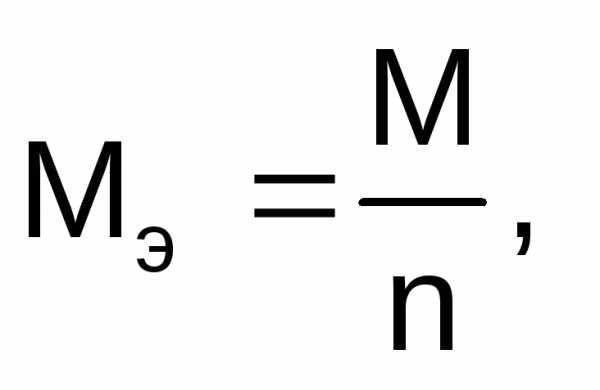
где М – молярная масса вещества, г/моль;
n – число электронов, участвующих в электродном процессе.
Для расчета объемов газообразных продуктов электролиза в законе Фарадея молярная масса эквивалентов вещества Мэ заменяется на молярный объем эквивалента газа при нормальных условиях (Vэ), который рассчитывается по формуле:

где 22,4 – это объем, который занимает 1 моль любого газа при нормальных условиях, л; n – число  , отданных или принятых 1 моль газа.
, отданных или принятых 1 моль газа.
При проведении электролиза в реальных условиях, вследствие побочных процессов масса вещества, выделившегося на электроде, оказывается меньше массы, рассчитанной по закону Фарадея. Отношение массы вещества, полученной при электролизе (mпракт.) к массе вещества, рассчитанной по закону Фарадея (mтеор.), выраженное в процентах, называется выходом по току (Вт):

Пример 1. Составьте электронные уравнения электродных процессов, протекающих при электролизе раствора CuSO4. Определите массу меди и объем газа, выделившихся на электродах при прохождении тока силой 5 А в течение 2 часов.
Решение. В водном растворе CuSO4 диссоциирует по схеме
CuSO4 Cu2+ + SO42–
При электролизе раствора соли CuSO4 на катоде будут восстанавливаться ионы Cu2+, а на аноде – окисляться молекулы воды.
Катод (–):Cu2+ + 2 Cu 2
Cu 2
Анод (+): 2Н2О - 4 О2 + 4Н+ 1
О2 + 4Н+ 1
Суммарная реакция: 2CuSO4 + 2h3O 2Cu + O2 + 2h3SO4
Молекулы h3SO4 образуются в результате побочной реакции между ионами Н+ и кислотными остатками SO42–, которые накапливаются у поверхности анода.
Масса меди, выделившейся на катоде:
Объем кислорода, выделившегося на аноде:
Ответ: m(Сг)=11,85 г;
Пример 2. Составьте схему электролиза водного раствора соли NaCl и рассчитайте массу образовавшегося на катоде гидроксида натрия, если на аноде выделилось 1,12 л газа.
Решение. В водном растворе NaCl диссоциирует по схеме:
NaCl Na+ + Cl–
При электролизе раствора NaCl на катоде будет восстанавливаться водород из молекул воды, а на аноде – окисляться ионы Cl– до газообразного Cl2:
Катод (–): 2Н2О + 2 Н2 + 2ОН– 1
Н2 + 2ОН– 1
Анод (+): 2Cl– - 2 Cl2 1
Cl2 1
Суммарная реакция: 2NaCl + 2h3O h3 + 2NaOH + Cl2
Молекулы NaОН образуются в результате взаимодействия ионов ОН– с ионами Na+, которые накапливаются у поверхности катода.
Молярный объем эквивалента хлора:
Количество эквивалентов хлора:
Так как на электродах выделяется одинаковое количество эквивалентов веществ, то
nэ(NaOH) = 0,1 моль.
Масса образовавшегося NaOH:
n(NaOH) = Mэ(NaOH)nэ(NaOH) = 40 0,1 = 4 г.
Ответ: 4 г.
Пример 3. Определите массу цинка, который выделится на катоде при электролизе сульфата цинка в течение 1 часа при токе 26,8 А, если выход цинка по току равен 58%. Составьте схему электродных процессов.
Решение. Согласно закону Фарадея масса выделившегося цинка:
С учетом выхода по току практически выделившаяся масса цинка:
Схема электролиза раствораZnSO4:
ZnSO4 Zn2+ + SO42–
К
1
атод (–):Zn2+ + 2 Zn
Zn 2h3O + 2 h3 + 2OH–
h3 + 2OH–
Анод (+): 2h3O - 4 O2 + 4H+ 1
O2 + 4H+ 1
Cуммарная реакция:
2ZnSO4 + 4h3O Zn + h3 + Zn(OH)2 + O2 + 2h3SO4
Низкий выход по току цинка объясняется тем, что одновременно с цинком на катоде восстанавливаются молекулы воды и часть электричества расходуется на этот процесс.
Ответ: 18,96 г.
studfiles.net
Электролиз. Законы фарадея
Окислительно-восстановительный процесс, принудительно протекающий под действием электрического тока, называется электролизом.
Электролиз проводят в электролизере, заполненном электролитом, в который погружены электроды, подсоединенные к внешнему источнику тока.
Электрод, подсоединенный к отрицательному полюсу внешнего источника тока, называется катодом. На катоде протекают процессы восстановления частиц электролита. Электрод, подсоединенный к положительному полюсу источника тока, называется анодом. На аноде протекают процессы окисления частиц электролита или материала электрода.
Анодные процессы зависят от природы электролита и материала анода. В связи с этим различают электролиз с инертным и растворимым анодом.
Инертным называется анод, материал которого не окисляется в ходе электролиза. К инертным электродам относятся, например, графитовый (угольный) и платиновый.
Растворимым называется анод, материал которого может окисляться в ходе электролиза. Большинство металлических электродов являются растворимыми.
В качестве электролита могут быть использованы растворы или расплавы. В растворе или расплаве электролита ионы находятся в хаотичном движении. Под действием электрического тока ионы приобретают направленное движение: катионы движутся к катоду, а анионы - к аноду и, соответственно, на электродах они могут разряжаться.
При электролизе расплавов с инертными электродами на катоде возможно восстановление только катионов металла, а на аноде − окисление анионов.
При электролизе водных растворов на катоде кроме катионов металла, могут восстанавливаться молекулы воды, а в кислых растворах - ионы водорода Н+. Таким образом, на катоде возможны следующие конкурирующие реакции:
(-) К: Меn+ + nē → Me
2h3O + 2 ē → h3 + 2 OH-
2Н+ + 2 ē → Н2
26
На катоде в первую очередь протекает реакция с наибольшим значением электродного потенциала.
При электролизе водных растворов с растворимым анодом, кроме окисления анионов, возможны реакции окисления самого электрода, молекул воды и в щелочных растворах гидроксид-ионов (ОН-):
(+) А: Me - n ē → Меn+
окисление аниона Е0
2h3O – 4 ē O2 + 4 H+
4OH–- 4 ē = O2 +2h3O
На аноде в первую очередь протекает реакция с наименьшим значением электродного потенциала.
Для электродных реакций приведены равновесные потенциалы в отсутствии электрического тока.
Электролиз - процесс неравновесный, поэтому потенциалы электродных реакций под током отличаются от своих равновесных значений. Смещение потенциала электрода от его равновесного значения под влиянием внешнего тока называется электродной поляризацией. Величина поляризации называется перенапряжением. На величину перенапряжения влияют многие факторы: природа материала электрода, плотность тока, температура, рН-среды и др.
Перенапряжения катодного выделения металлов сравнительно невелики.
С высоким перенапряжением, как правило, протекает процесс образования газов, таких как водород и кислород. Минимальное перенапряжение водорода на катоде в кислых растворах наблюдается на Pt (=0,1 В), а максимальное −на свинце, цинке, кадмии и ртути. Перенапряжение изменяется при замене кислых растворов на щелочные. Например, на платине в щелочной среде перенапряжение водорода =0,31 В (см. приложение).
Анодное выделение кислорода также связано с перенапряжением. Минимальное перенапряжение выделения кислорода наблюдается на Pt-электродах (=0,7 В), а максимальное − на цинке, ртути и свинце (см. приложение).
27
Из вышеизложенного следует, что при электролизе водных растворов:
1) на катоде восстанавливаются ионы металлов, электродные потенциалы которых больше потенциала восстановления воды (-0,82В). Ионы металлов, имеющие более отрицательные электродные потенциалы чем -0,82В, не восстанавливаются. К ним относятся ионы щелочных и щелочноземельных металлов и алюминия.
2) на инертном аноде с учетом перенапряжения кислорода протекает окисление тех анионов, потенциал которых меньше потенциала окисления воды (+1,23В). К таким анионам относятся, например, I-, Br-, Cl-, NO2-, ОН-. Анионы СO32-, РO43-, NO3-, F- - не окисляемы.
3) при электролизе с растворимым анодом, в нейтральных и кислых средах растворяются электроды из тех металлов, электродный потенциал которых меньше +1,23В, а в щелочных – меньше, чем +0,413В.
Суммарными продуктами процессов на катоде и аноде являются электронейтральные вещества.
Для осуществления процесса электролиза на электроды необходимо подать напряжение. Напряжение электролиза Uэл-за – это разность потенциалов, необходимая для протекания реакций на катоде и аноде. Теоретическое напряжение электролиза (Uэл-за, теор) без учета перенапряжения, омического падения напряжения в проводниках первого рода и в электролите
Uэл-за, теор = Eа – Eк , (7)
где Eа , Eк - потенциалы анодных и катодных реакций.
Связь между количеством выделившегося при электролизе вещества и количеством прошедшего через электролит тока выражается двумя законами Фарадея.
I закон Фарадея. Количество вещества, образовавшегося на электроде при электролизе, прямо пропорционально количеству электричества, прошедшему через раствор (расплав) электролита:
, (8)
28
где k – электрохимический эквивалент, г/Кл или г/А·ч; Q – количество электричества, Кулон, Q =It; t-время, с; I-ток, А; F = 96500 Кл/моль (А·с/моль) = 26,8 А·ч/моль – постоянная Фарадея; Э- эквивалентная масса вещества, г/моль.
В электрохимических реакциях эквивалентная масса вещества определяется:
. (9)
n –число электронов, участвующих в электродной реакции образования этого вещества.
II закон Фарадея. При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на электродах, пропорциональны их эквивалентным массам:
, (10)
где m1 и m2 – массы веществ 1 и 2, Э1 и Э2, г/моль – эквивалентные массы веществ 1 и 2.
На практике часто вследствие протекания конкурирующих окислительно-восстановительных процессов на электродах образуется меньше вещества, чем соответствует прошедшему через раствор электричеству.
Для характеристики потерь электричества при электролизе введено понятие «Выход по току». Выходом по току Вт называется выраженное в процентах отношение количества фактически полученного продукта электролиза mфакт. к теоретически рассчитанному mтеор:
Пример 10. Какие процессы будут протекать при электролизе водного раствора сульфата натрия с угольным анодом? Какие вещества будут выделяться на электродах, если угольный электрод заменить на медный?
Решение: В растворе сульфата натрия в электродных процессах могут участвовать ионы натрия Na+, SO42- и молекулы воды. Угольные электроды относятся к инертным электродам.
На катоде возможны следующие процессы восстановления:
29
(-) К: Na+ + ē → Na
2h3O + 2 ē → h3 + 2 OH-
На катоде в первую очередь протекает реакция с наибольшим значением электродного потенциала. Поэтому на катоде будет происходить восстановление молекул воды, сопровождающееся выделением водорода и образованием в прикатодном пространстве гидроксид- ионов ОН-. Имеющиеся у катода ионы натрия Na+ совместно с ионами ОН- будут образовывать раствор щелочи NaOH.
На аноде возможны следующие реакции:
(+)А: 2 SO42- - 2 ē → S2O82-
2 h3O - 4 ē → 4H+ + O2.
На аноде в первую очередь протекает реакция с наименьшим значением электродного потенциала. Поэтому на аноде будет протекать окисление молекул воды с выделением кислорода, а в прианодном пространстве накапливаются ионы Н+. Имеющиеся у анода ионы SO42- с ионами Н+ будут образовывать раствор серной кислоты h3SO4.
Суммарная реакция электролиза выражается уравнением:
2 Na2SO4 + 6h3O = 2h3 + 4 NaOH + O2 + 2h3SO4.
катодные продукты анодные продукты
При замене угольного (инертного) анода на медный на аноде становится возможным протекание еще одной реакции окисления – растворение меди:
Cu – 2 ē → Cu2+
Этот процесс характеризуется меньшим значением потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе Na2SO4 с медным анодом на аноде пройдет окисление меди, а в анодном пространстве будет накапливаться сульфат меди CuSO4. Cуммарная реакция электролиза выразится уравнением:
Na2SO4 + 2h3O + Cu = h3 + 2 NaOH + CuSO4.
катодные продукты анодный продукт
Пример 11. Составьте уравнение процессов, протекающих при электролизе водного раствора хлорида никеля NiCl2 с инертным анодом.
30
Решение: В растворе хлорида никеля в электродных процессах могут участвовать ионы никеля Ni2+, Cl- и молекулы воды. В качестве инертного анода можно использовать графитовый электрод.
На катоде возможны следующие реакции:
(-) К: Ni2+ + 2 ē → Ni
2h3O + 2 ē → h3 + 2 OH-
Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов никеля.
На аноде возможны следующие реакции:
(+) А: 2 Cl- - 2 ē → Cl2
2h3O – 4 ē O2 + 4 H+.
Согласно величинам стандартных электродных потенциалов на аноде
должен выделяться кислород. В действительности, из-за высокого перенапряжения кислорода на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода составляет 1,17 В при плотности тока равной 1а/см2, что повышает потенциал окисления воды до 2,4 В.
Следовательно, электролиз раствора хлорида никеля протекает с образованием никеля и хлора:
Ni2+ + 2Cl- = Ni + Cl2.
на катоде на аноде
Пример 12. Вычислить массу вещества и объем газа, выделившихся на инертных электродах при электролизе водного раствора нитрата серебра AgNO3, если время электролиза составляет 25 мин, а сила тока 3 А.
Решение. При электролизе водного раствора AgNO3 в случае с нерастворимым анодом (например, графитовый) на электродах протекают процессы:
(-) К: Ag+ + ē → Ag ,
2h3O + 2 ē → h3 + 2OH- .
Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов серебра.
(+) A: 2h3O – 4 ē O2 + 4 H+,
анион NO3- не окисляем.
31
Анодные и катодные процессы связаны между собой: восстановление на катоде идет в той мере, в какой идет окисление на аноде. Другими словами, число электронов в анодной и катодной реакции должно быть одинаково, следовательно, катодную реакцию необходимо домножить на 4.
Суммарное уравнение электролиза нитрата серебра AgNO3:
4 AgNO3 + 2h3O = 4Ag + O2 + 4HNO3
на катоде анодные продукты
На катоде выделяется серебро. Эквивалентная масса cеребра г/моль. Массу серебра рассчитываем по первому закону Фарадея:. На аноде образуется кислород. Эквивалентная масса кислородаг/моль. Массу кислорода рассчитываем по второму закону Фарадея:, откудаг или в литрахл.
studfiles.net
Т. Законы электролиза — PhysBook
Закон электролиза. Определение заряда электрона
Закон Фарадея для электролиза связывает массу выделяющегося вещества с прошедшим через электролит электрическим зарядом. При прохождении электрического тока через электролит происходит выделение на электродах составных частей электролита. Это явление называется электролизом (от греческого "лио" — разделяю). Электролиз связан с процессами обмена зарядами между ионами и электродами. На аноде отрицательно заряженные ионы (анионы) отдают свои лишние электроны (окислительная реакция), а на катоде положительные ионы (катионы) получают недостающие электроны (восстановительная реакция). Отдав свои избыточные заряды, ионы превращаются в нейтральные атомы. Эти атомы (или образованные из них молекулы выделяются на электродах, либо вступают в реакцию с электродами или растворителем. Химические реакции, в которые вступают нейтрализовавшиеся ионы, называются вторичными. Продукты вторичных реакций выделяются на электродах или переходят в раствор.
Рассмотрим несколько примеров, выражающих суть электролиза.
Пример 1
Пусть в электролитической ванне находится водный раствор соляной кислоты. Молекулы соляной кислоты при растворении в воде почти полностью диссоциируют на ионы водорода и ионы хлора:
\(~HCl \leftrightarrows H^+ + Cl^-.\)При прохождении электрического тока через раствор на электродах происходит нейтрализация ионов.
Подойдя к аноду, Cl- отдает избыточный электрон, превращается в нейтральный атом Cl, атомы Cl сразу же объединяются попарно в молекулы Cl2:
\(~Cl^- + Cl^- - 2e \to Cl_2,\)и на аноде выделяется молекулярный хлор.
Атомы водорода, нейтрализовавшиеся у катода, объединяются попарно в молекулы h3:
\(~H^+ + H^+ + 2e \to H_2,\)и на катоде выделяется молекулярный водород.
Таким образом, в результате прохождения электрического тока через водный раствор HCl на катоде выделяется водород, на аноде — хлор. Вторичных реакций не происходит.
Пример 2
Молекулы серной кислоты при растворении в воде диссоциируют на ионы водорода и ионы кислотного остатка:
\(~H_2SO_4 \leftrightarrows 2H^+ + SO_4^{2-}.\)При прохождении электрического тока через раствор на электродах протекают следующие реакции:
\(~2H^+ + 2e \to H_2,\) \(~SO_4^{2-} - 2e \to SO_4.\)Водород выделяется в виде пузырьков на катоде. Нейтральная группа SO4 химически очень активна и вступает во вторичную реакцию. Если электроды изготовлены, например, из платины или никеля, то SO4 реагирует с водой:
\(~2SO_4 + 2H_2O \to 2H_2SO_4 + O_2.\)Молекула серной кислоты поступает в раствор, кислород выделяется в виде пузырьков у анода, т.е. вторичная реакция протекает с растворителем.
Пример 3
Пусть в электролитической ванне находится водный раствор сульфата меди. Под действием растворителя молекулы сульфата меди диссоциируют на ионы меди и ионы кислотного остатка:
\(~CuSO_4 \leftrightarrows Cu^{2+} + SO_4^{2-}.\)При прохождении электрического тока через раствор на катоде ионы меди превращаются в нейтральные атомы \(~Cu^{2+} + 2e \to Cu\), и медь откладывается на катоде. На аноде происходит нейтрализация комплекса SO42-\[~SO_4^{2-} - 2e \to SO_4.\].
Если электроды медные, то нейтральная группа SO4 предпочтительнее вступает в реакцию с медью, чем с водой\[~SO_4 + Cu \to CuSO_4.\].
Молекула CuSO4 поступает в раствор. Вторичная реакция протекает с электродом из меди. Происходит отложение меди на катоде и растворение анода. Химический состав электролита при этом остается неизменным.
Необходимым условием электролиза является прохождение через электролит постоянного электрического тока.
Массу вещества, выделившегося при электролизе, можно рассчитать, пользуясь электронной теорией. Эта масса определяется массой всех N ионов, которые осели на электроде: m = m0N, где m0 — масса одного иона, N — число ионов, которое можно рассчитать, зная массу вещества m и его молярную массу М\[~N = \frac mM N_A\], где NA — число Авогадро.
С другой стороны, число ионов можно выразить через заряд q, про-шедший через электролит, и заряд одного иона qi\[~N = \frac{q}{q_i}\].
Следовательно, \(~\frac{q}{q_i} = \frac mM N_A \Rightarrow m = \frac{qM}{q_i N_A}\).
Заряд иона любого вещества кратен заряду одновалентного иона, т.е. заряду электрона qi = ne, где n — валентность иона.
Таким образом,
\(~m = \frac{M}{ne N_A} q . \qquad (1)\)Величины Μ и n постоянны для данного вещества. Поэтому выражение \(~\frac{M}{ne N_A} = k\) — величина постоянная для данного вещества. Ее называют электрохимическим эквивалентом. Тогда m = kq.
Приведенная зависимость впервые была экспериментально установлена М. Фарадеем в 30-х годах XIX века. Эта формула выражает закон Фарадея: масса вещества, выделившегося на электроде, прямо пропорциональна заряду q. прошедшему через электролит:
\(~m = kq .\)Электрохимический эквивалент численно равен массе вещества, выделившегося на электроде при прохождении через раствор электролита заряда в 1 Кл. В СИ единицей электрохимического эквивалента является килограмм на кулон (кг/Кл) .
Убедиться в справедливости закона Фарадея можно на опыте. Соберем установку, показанную на рисунке 1. Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов через I1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 выделившихся на электродах веществ в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам тока I1, I2, I3.

Рис. 1
Закон Фарадея сыграл важную роль в истории развития физики. Именно закон, полученный Фарадеем опытным путем, послужил толчком к выдвижению гипотезы о существовании в природе элементарного электрического заряда. Закон Фарадея позволяет определить заряд одновалентного иона (заряд электрона). Из формулы (1) \(~e = \frac{Mq}{m N_A n} = \frac{Mq}{m N_A} = \frac{MIt}{m N_A}\), т.е. надо измерить на опыте только массу выделившегося вещества m и силу тока в цепи I.
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 283-286.
www.physbook.ru
ЭЛЕКТРОЛИЗ. ЗАКОНЫ ФАРАДЕЯ — Мегаобучалка
Окислительно-восстановительный процесс, принудительно протекающий под действием электрического тока, называется электролизом.
Электролиз проводят в электролизере, заполненном электролитом, в который погружены электроды, подсоединенные к внешнему источнику тока.
Электрод, подсоединенный к отрицательному полюсу внешнего источника тока, называется катодом. На катоде протекают процессы восстановления частиц электролита. Электрод, подсоединенный к положительному полюсу источника тока, называется анодом. На аноде протекают процессы окисления частиц электролита или материала электрода.
Анодные процессы зависят от природы электролита и материала анода. В связи с этим различают электролиз с инертным и растворимым анодом.
Инертным называется анод, материал которого не окисляется в ходе электролиза. К инертным электродам относятся, например, графитовый (угольный) и платиновый.
Растворимым называется анод, материал которого может окисляться в ходе электролиза. Большинство металлических электродов являются растворимыми.
В качестве электролита могут быть использованы растворы или расплавы. В растворе или расплаве электролита ионы находятся в хаотичном движении. Под действием электрического тока ионы приобретают направленное движение: катионы движутся к катоду, а анионы - к аноду и, соответственно, на электродах они могут разряжаться.
При электролизе расплавов с инертными электродами на катоде возможно восстановление только катионов металла, а на аноде − окисление анионов.
При электролизе водных растворов на катоде кроме катионов металла, могут восстанавливаться молекулы воды, а в кислых растворах - ионы водорода Н+. Таким образом, на катоде возможны следующие конкурирующие реакции:
(-) К: Меn+ + nē → Me
2h3O + 2 ē → h3 + 2 OH-
2Н+ + 2 ē → Н2
На катоде в первую очередь протекает реакция с наибольшим значением электродного потенциала.
При электролизе водных растворов с растворимым анодом, кроме окисления анионов, возможны реакции окисления самого электрода, молекул воды и в щелочных растворах гидроксид-ионов (ОН-):
(+) А: Me - n ē → Меn+
окисление аниона Е0
2h3O – 4 ē O2 + 4 H+
4OH–- 4 ē = O2 +2h3O
На аноде в первую очередь протекает реакция с наименьшим значением электродного потенциала.
Для электродных реакций приведены равновесные потенциалы в отсутствии электрического тока.
Электролиз - процесс неравновесный, поэтому потенциалы электродных реакций под током отличаются от своих равновесных значений. Смещение потенциала электрода от его равновесного значения под влиянием внешнего тока называется электродной поляризацией. Величина поляризации называется перенапряжением. На величину перенапряжения влияют многие факторы: природа материала электрода, плотность тока, температура, рН-среды и др.
Перенапряжения катодного выделения металлов сравнительно невелики.
С высоким перенапряжением, как правило, протекает процесс образования газов, таких как водород и кислород. Минимальное перенапряжение водорода на катоде в кислых растворах наблюдается на Pt (h=0,1 В), а максимальное −на свинце, цинке, кадмии и ртути. Перенапряжение изменяется при замене кислых растворов на щелочные. Например, на платине в щелочной среде перенапряжение водорода h=0,31 В (см. приложение).
Анодное выделение кислорода также связано с перенапряжением. Минимальное перенапряжение выделения кислорода наблюдается на Pt-электродах (h=0,7 В), а максимальное − на цинке, ртути и свинце (см. приложение).
Из вышеизложенного следует, что при электролизе водных растворов:
1) на катоде восстанавливаются ионы металлов, электродные потенциалы которых больше потенциала восстановления воды (-0,82В). Ионы металлов, имеющие более отрицательные электродные потенциалы чем -0,82В, не восстанавливаются. К ним относятся ионы щелочных и щелочноземельных металлов и алюминия.
2) на инертном аноде с учетом перенапряжения кислорода протекает окисление тех анионов, потенциал которых меньше потенциала окисления воды (+1,23В). К таким анионам относятся, например, I-, Br-, Cl-, NO2-, ОН-. Анионы СO32-, РO43-, NO3-, F- - не окисляемы.
3) при электролизе с растворимым анодом, в нейтральных и кислых средах растворяются электроды из тех металлов, электродный потенциал которых меньше +1,23В, а в щелочных – меньше, чем +0,413В.
Суммарными продуктами процессов на катоде и аноде являются электронейтральные вещества.
Для осуществления процесса электролиза на электроды необходимо подать напряжение. Напряжение электролиза Uэл-за – это разность потенциалов, необходимая для протекания реакций на катоде и аноде. Теоретическое напряжение электролиза (Uэл-за, теор) без учета перенапряжения, омического падения напряжения в проводниках первого рода и в электролите
Uэл-за, теор= Eа – Eк , (7)
где Eа , Eк - потенциалы анодных и катодных реакций.
Связь между количеством выделившегося при электролизе вещества и количеством прошедшего через электролит тока выражается двумя законами Фарадея.
I закон Фарадея.Количество вещества, образовавшегося на электроде при электролизе, прямо пропорционально количеству электричества, прошедшему через раствор (расплав) электролита:
, (8)
где k – электрохимический эквивалент, г/Кл или г/А·ч; Q – количество электричества, Кулон, Q =It; t-время, с; I-ток, А; F = 96500 Кл/моль (А·с/моль) = 26,8 А·ч/моль – постоянная Фарадея; Э- эквивалентная масса вещества, г/моль.
В электрохимических реакциях эквивалентная масса вещества определяется:
. (9)
n –число электронов, участвующих в электродной реакции образования этого вещества.
II закон Фарадея.При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на электродах, пропорциональны их эквивалентным массам:
, (10)
где m1 и m2 – массы веществ 1 и 2, Э1 и Э2, г/моль – эквивалентные массы веществ 1 и 2.
На практике часто вследствие протекания конкурирующих окислительно-восстановительных процессов на электродах образуется меньше вещества, чем соответствует прошедшему через раствор электричеству.
Для характеристики потерь электричества при электролизе введено понятие «Выход по току». Выходом по току Втназывается выраженное в процентах отношение количества фактически полученного продукта электролиза mфакт. к теоретически рассчитанному mтеор:
Пример 10. Какие процессы будут протекать при электролизе водного раствора сульфата натрия с угольным анодом? Какие вещества будут выделяться на электродах, если угольный электрод заменить на медный?
Решение: В растворе сульфата натрия в электродных процессах могут участвовать ионы натрия Na+, SO42- и молекулы воды. Угольные электроды относятся к инертным электродам.
На катоде возможны следующие процессы восстановления:
(-) К: Na+ + ē → Na
2h3O + 2 ē → h3 + 2 OH-
На катоде в первую очередь протекает реакция с наибольшим значением электродного потенциала. Поэтому на катоде будет происходить восстановление молекул воды, сопровождающееся выделением водорода и образованием в прикатодном пространстве гидроксид- ионов ОН-. Имеющиеся у катода ионы натрия Na+ совместно с ионами ОН- будут образовывать раствор щелочи NaOH.
На аноде возможны следующие реакции:
(+)А: 2 SO42- - 2 ē → S2O82-
2 h3O - 4 ē → 4H+ + O2 .
На аноде в первую очередь протекает реакция с наименьшим значением электродного потенциала. Поэтому на аноде будет протекать окисление молекул воды с выделением кислорода, а в прианодном пространстве накапливаются ионы Н+. Имеющиеся у анода ионы SO42- с ионами Н+ будут образовывать раствор серной кислоты h3SO4.
Суммарная реакция электролиза выражается уравнением:
2 Na2SO4 + 6h3O = 2h3 + 4 NaOH + O2 + 2h3SO4.
катодные продукты анодные продукты
При замене угольного (инертного) анода на медный на аноде становится возможным протекание еще одной реакции окисления – растворение меди:
Cu – 2 ē → Cu2+
Этот процесс характеризуется меньшим значением потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе Na2SO4 с медным анодом на аноде пройдет окисление меди, а в анодном пространстве будет накапливаться сульфат меди CuSO4. Cуммарная реакция электролиза выразится уравнением:
Na2SO4 + 2h3O + Cu = h3 + 2 NaOH + CuSO4.
катодные продукты анодный продукт
Пример 11. Составьте уравнение процессов, протекающих при электролизе водного раствора хлорида никеля NiCl2 с инертным анодом.
Решение: В растворе хлорида никеля в электродных процессах могут участвовать ионы никеля Ni2+, Cl- и молекулы воды. В качестве инертного анода можно использовать графитовый электрод.
На катоде возможны следующие реакции:
(-) К: Ni2+ + 2 ē → Ni
2h3O + 2 ē → h3 + 2 OH-
Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов никеля.
На аноде возможны следующие реакции:
(+) А: 2 Cl- - 2 ē → Cl2
2h3O – 4 ē O2 + 4 H+ .
Согласно величинам стандартных электродных потенциалов на аноде
должен выделяться кислород. В действительности, из-за высокого перенапряжения кислорода на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода составляет 1,17 В при плотности тока равной 1а/см2, что повышает потенциал окисления воды до 2,4 В.
Следовательно, электролиз раствора хлорида никеля протекает с образованием никеля и хлора:
Ni2+ + 2Cl- = Ni + Cl2.
на катоде на аноде
Пример 12. Вычислить массу вещества и объем газа, выделившихся на инертных электродах при электролизе водного раствора нитрата серебра AgNO3, если время электролиза составляет 25 мин, а сила тока 3 А.
Решение. При электролизе водного раствора AgNO3 в случае с нерастворимым анодом (например, графитовый) на электродах протекают процессы:
(-) К: Ag+ + ē → Ag ,
2h3O + 2 ē → h3 + 2OH- .
Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов серебра.
(+) A: 2h3O – 4 ē O2 + 4 H+ ,
анион NO3- не окисляем.
Анодные и катодные процессы связаны между собой: восстановление на катоде идет в той мере, в какой идет окисление на аноде. Другими словами, число электронов в анодной и катодной реакции должно быть одинаково, следовательно, катодную реакцию необходимо домножить на 4.
Суммарное уравнение электролиза нитрата серебра AgNO3:
4 AgNO3 + 2h3O = 4Ag + O2 + 4HNO3
на катоде анодные продукты
На катоде выделяется серебро. Эквивалентная масса cеребра г/моль. Массу серебра рассчитываем по первому закону Фарадея: . На аноде образуется кислород. Эквивалентная масса кислорода г/моль. Массу кислорода рассчитываем по второму закону Фарадея : , откуда г или в литрах л.
Задания
5.Записать реакции электролиза на инертных электродах и вычислить массу вещества, полученного на катоде, и объем газа, выделившегося на аноде, при электролизе растворов электролитов, если время электролиза 20 минут, сила тока I=2А, если выход по току Вт=100%. Какие вещества будут выделяться на электродах при замене инертного анода на металлический, указанный в задании?
Таблица
| №№ | Электролит | Металлический электрод |
| CuSO4 | Cu | |
| MgCl2 | Ni | |
| Zn(NO3)2 | Zn | |
| SnF2 | Sn | |
| CdSO4 | Cd | |
| FeCl2 | Fe | |
| AgNO3 | Ag | |
| HCl | Co | |
| CoSO4 | Co | |
| NiCl2 | Ni |
Окончание таблицы
megaobuchalka.ru
Законы электролиза Фарадея - это... Что такое Законы электролиза Фарадея?
Майкл Фарадей, портрет Томаса Филипса, 1841-1842Зако́ны электро́лиза Фараде́я являются количественными соотношениями, основанными на электрохимических исследованиях, опубликованных Майклом Фарадеем в 1836 году.[1]
Формулировка законов
В учебниках и научной литературе можно найти несколько версий формулировки законов. В наиболее общем виде законы формулируются следующим образом:
- Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
- Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Математический вид
Законы Фарадея можно записать в виде следующей формулы:
где:
- m — масса осаждённого на электроде вещества в граммах
- Q — полный электрический заряд, прошедший через вещество
- F = 96 485,3383(83) Кл·моль−1 — постоянная Фарадея
- M — молярная масса вещества
- z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества.
Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m.
Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
В простейшем случае постоянного тока электролиза приводит к:
и тогда
где:
В более сложном случае переменного электрического тока полный заряд Q тока I() суммируется за время :
Здесь t — полное время электролиза. Обратите внимание, что тау используется в качестве переменной, ток I является функцией от тау.[2]
Примечания
- ↑ Ehl, Rosemary Gene; Ihde, Aaron (1954). «Faraday's Electrochemical Laws and the Determination of Equivalent Weights». Journal of Chemical Education 31 (May): 226–232. DOI:10.1021/ed031p226. Bibcode: 1954JChEd..31..226E.
- ↑ For a similar treatment, see Strong, F. C. (1961). «Faraday's Laws in One Equation». Journal of Chemical Education 38 (2): 98. DOI:10.1021/ed038p98.
Ссылки
- Serway, Moses, and Moyer, Modern Physics, third edition (2005).
См. также
dic.academic.ru
Законы электролиза Фарадея — WiKi
Майкл Фарадей, портрет Томаса Филипса, 1841—1842Зако́ны электро́лиза Фараде́я являются количественными соотношениями, основанными на электрохимических исследованиях, опубликованных Майклом Фарадеем в 1836 году.[1]
Законы Фарадея можно записать в виде следующей формулы:
m = (QF)(Mz),{\displaystyle m\ =\ \left({Q \over F}\right)\left({M \over z}\right),}где:
Заметим, что M/z{\displaystyle M/z} — это эквивалентная масса осаждённого вещества.
Для первого закона Фарадея M,F{\displaystyle M,\,F} и z{\displaystyle z} являются константами, так что, чем больше величина Q{\displaystyle Q} , тем больше будет величина m{\displaystyle m} .
Для второго закона Фарадея Q,F{\displaystyle Q,\,F} и z{\displaystyle z} являются константами, так что чем больше величина M/z{\displaystyle M/z} (эквивалентная масса), тем больше будет величина m{\displaystyle m} .
В простейшем случае постоянного тока электролиза Q=It{\displaystyle Q=It} приводит к:
m = (ItF)(Mz),{\displaystyle m\ =\ \left({It \over F}\right)\left({M \over z}\right),}и тогда
n = (ItF)(1z),{\displaystyle n\ =\ \left({It \over F}\right)\left({1 \over z}\right),}где:
- n{\displaystyle n} — выделенное количество вещества («количество молей»): n=m/M{\displaystyle n=m/M} ,
- t{\displaystyle t} — время действия постоянного тока.
В более сложном случае переменного электрического тока полный заряд Q{\displaystyle Q} тока I(τ){\displaystyle I(\tau )} суммируется за время τ{\displaystyle \tau } :
Q=∫0tI dτ.{\displaystyle Q=\int _{0}^{t}I\ d\tau .}Здесь t{\displaystyle t} — полное время электролиза. Обратите внимание, что τ{\displaystyle \tau } используется в качестве переменной, ток I{\displaystyle I} является функцией от τ{\displaystyle \tau } .[2]
ru-wiki.org